Методика паразитологического инспектирования рыбы
Лабораторная работа № 10. Методы паразитологического инспектирования морской рыбы и рыбной продукции (морская
Методы паразитологического инспектирования морской рыбы и рыбной продукции (морская рыба-сырец, рыба охлажденная и мороженая)
(4 часа)
Содержание. Освоение общих положений и порядка полного паразитологического вскрытия рыб.
Материальное обеспечение. Столик или иное приспособление с прозрачной (из стекла или плексигласа) верхней крышкой (размером не менее, чем 40×40 см) и электрической подсветкой снизу. Используется для просмотра филе на просвет. Бинокуляр (или стереомикроскоп) любой марки (типа МБС-1,МБС-2, МБС-9, МБС-10 и т.д.). Головная (ила налобная) лупа любого типа (БЛ-2 или др.). Микроскоп любой марки (типа МБИ, Биолам и т.д.). Предметные и покровные стекла. Компрессорий — вырезанная из толстого стекла (толщиной от 3 до 5 мм) пара прямоугольных пластин размером от 10×15 см до 20×20 см. Медицинские скальпели средних размеров и медицинские ножницы (хирургические) средних размеров. Пинцеты (анатомические или хирургические) средних размеров, а также мелкие глазные для удерживания участков ткани при вскрытии и выбирания паразитов из тканей. Пипетки глазные для выбирания мелких паразитов из жидкости. Препаровальные иглы (толстые иглы с пластмассовыми ручками) для извлечения паразитов из тканей, капсул или цист, для проверки жизнеспособности личинок гельминтов. Чашки Петри. Пенициллиновые пузырьки с пробками и стеклянные или пластмассовые пробирки различного размера. Спирт-ректификат используется при разведении до 70 °С в качестве фиксатора для трематод и цестод. Формалин используется при разведении до 4-10 %-ого в качестве фиксатора для нематод, скребней, ракообразных, простейших.
Общие положения
Задачи паразитологического инспектирования
Паразитические организмы являются нормальными сочленами биоценозов, и практически не существует ни одной взрослой особи тихоокеанских лососей, вернувшейся в пресноводные водоемы из моря, внутри или на поверхности тела которой, не содержалось бы таких организмов. Большинство их имеют микроскопические размеры, не причиняют рыбам вреда, не представляют опасности для человека. Такие паразиты не влияют на качество рыбного сырья и продукции, они незаметны или малозаметны и большей частью выявляются только при специальном паразитологическом исследовании. Поэтому сам по себе факт нахождения в морской рыбе паразитов еще не может быть основанием для браковки или снижения сортности.
Но среди паразитов, обитающих в морских рыбах, могут встречаться такие, которые опасны для здоровья человека, способны изменять физико-химические свойства рыбного сырья или портить товарный вид рыбы и рыбной продукции. Выявление таких паразитов и установление степени зараженности ими для последующего решения вопроса о возможности пищевого или иного использования сырья или продукции является задачей паразитологического инспектирования.
Паразитологическое инспектирование необходимого количества партий морской рыбы или соответствующей рыбной продукции в обязательном порядке проводится предварительно, а также в начальный период освоения новых объектов или новых районов промысла. В результате такого инспектирования выясняется необходимость дальнейшего контроля уровня зараженности аналогичных партий путем выборочного паразитологического инспектирования, методика контроля и его периодичность
Некоторые виды морской рыбы и рыбной продукции характеризуются всегда низким уровнем зараженности, не препятствующим их пищевому использованию. Необходимость проведения паразитологического инспектирования определяется в процессе приемки по качеству и возникает при любом подозрении на наличие в сырье или продукции паразитов, опасных для человека или снижающих качество.
Объем выборки должен быть 25 экз. каждого вида рыбы. Если рыба разделана на куски или филе, то отбирают 50 кусков или филе.
При получении неудовлетворительных результатов паразитологического инспектирования по паразитам, портящим товарный вид или качество продукции, но не представляющим опасности для человека, проводят повторное инспектирование продукции такого же объема выборки, как и первый. Результаты повторного инспектирования суммируются с результатами первичного, и этот суммарный результат распространяется на всю партию.
В случае обнаружения в рыбах инспектируемой выборки живых личинок гельминтов (хотя бы одного экземпляра), потенциально опасных для человека, продукция повторному паразитологическому инспектированию не подлежит; результат является окончательным.
Внешний осмотр
Каждый экземпляр дефростированной рыбы всех типов разделки сначала подвергают внешнему осмотру. Запись и, если нужно, сбор выявленных паразитов и поражений ведется отдельно по каждому экземпляру рыбы (филе или куску).
Осмотр проводится, как правило, невооруженным глазом, без использования лупы, бинокуляра или иных оптических устройств; ими можно пользоваться при извлечении паразитов или при уточнении их положения в тканях рыбы.
В результате внешнего осмотра выявляются:
а) визуально заметные паразиты или иные включения, которые могут быть приняты за паразитов, прикрепленные или прилипшие к поверхности тела, его полости или поверхности разрезов мяса рыбы, а также паразиты, полупогруженные в мясо или находящиеся там непосредственно под поверхностью и просвечивающие сквозь нее;
б) пятна и включения, отличающиеся по цвету или консистенции от окружающих их нормальных тканей рыбы, а также различные опухолевидные образования;
в) участки мяса разжиженной консистенции;
г) случаи плохого качества зачистки полости тела (у потрошеной рыбы), когда в полости тела остаются отдельные паразиты.
Как правило, паразиты характеризуются четкими контурами тела. Они могут обнаруживаться как в свободном, так и в инцистированном состоянии; в последнем случае их тело бывает одето шаровидной или вытянутой соединительнотканной оболочкой – цистой или капсулой. Максимальные размеры цист (которые всегда шаровидны) – до 3-4 мм, капсул (их форма может быть различной, но чаще всего вытянутая) – до нескольких сантиметров (иногда даже более 20 см). Двумя препаровальными иглами обычно нетрудно извлечь паразита из капсулы; извлечение паразитов из мелких цист требует определенного навыка.
Иногда цисты могут быть покрыты скоплением черного пигмента. Это бывает, например, при так называемом «чернопятнистом заболевании» тихоокеанских лососей, возбудителями которого могут служить инцистированные личинки некоторых трематод и нематод. Такие черные пятна диаметром от I до 5-6 мм встречаются в коже, под чешуей и очень редко в мясе.
Темные пятна на поверхности тела или в мясе тихоокеанских лососей могут быть следами прикрепления здесь паразитических ракообразных или некоторых других паразитов. Такие пятна обычно имеют расплывчатые контуры, характеризуются более крупными размерами (до 2-3 см в поперечнике) и иногда содержат внутри твердые включения – остатки головных частей паразитов. Подобные пятна следует вырезать для последующего исследования с участками окружающей нормальной ткани. Подобным же образом вырезаются и кусочки ткани с иными включениями.
Разжиженная консистенция мышечной ткани может указывать на поражение паразитическими простейшими — миксоспоридиями или микроспоридиями. Из мяса, имеющего признаки разжижения, нужно вырезать несколько кусочков (обычно не более 2×2×2 см) для последующего лабораторного исследования.
Отобранные для определения паразиты и кусочки ткани помещаются с соответствующими этикетками в небольшие сосуды (чашки Петри, солонки или часовые стекла) с подсоленной или морской водой.
«ПАРАЗИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ РЫБ»
Цель занятия: научится проводить полное и неполное паразитологическое исследование рыб.
Задания для практической работы: Провести неполное паразитологическое исследование разных видов рыб.
При паразитологические исследованиях клиническому осмотру подвергают не менее 100 рыб из каждого пруда, паразитологическому вскрытию — мальков 25 экз., годовиков 10–15, рыб старших возрастов 5–10 экз.
Порядок полного паразитологического исследования рыбы
Полное паразитологическое исследование рыб проводят по методикам, разработанным В. А. Догелем, Э. М. Ляйманом, А. П. Маркевичем.
Для полного паразитологического исследования желательно брать еще живую или только что «уснувшую» рыбу (вполне свежую), не помятую, не подсушенную и наименее поврежденную рыболовными орудиями.
Полное паразитологическое исследование производится по установленному плану ,в определенной последовательности изучения поверхности тела и отдельных органов вскрытой рыбы. Сначала рыба измеряется и взвешивается (измерение и взвешивание нужно производить возможно более быстро, следя за тем, чтобы рыба не подсыхала),а затем подвергают клиническому осмотру. Тогда же берется чешу, для определения возраста. Затем производится обследование жабер и ротовой полости. После этого следует приступать к полному паразитологическому вскрытию. Кровь и сердце надлежит исследовать у возможно более свежей рыбы, т. е. мазок крови делается перед наружным осмотром, сердце исследуется после вскрытия рыбы, в первую очередь. Полость тела обследуется как сразу по вскрытии ее, так и по мере просмотра отдельных органов, так как паразиты, находящиеся на поверхности органов, в жировой ткани и брюшине, относятся к полостным паразитам.
Органы и ткани следует осматривать всегда в одной и той же последовательности. Только тогда будет исключена возможность того, что какой-то участок окажется «забытым» и пропущенным. Исходя из топографического расположения органов, большинство ихтиопаразитологов принимает следующую очередность в исследовании: 1) сердце, 2) мочевой пузырь, 3) желчный пузырь, 4) печень, 5) селезенка, 6) жировая ткань, 7) брюшина, 8) кишечник, 9) половые железы, 10) плавательный пузырь, 11) почки, 12) глаза, 13) головной мозг, 14) спинной мозг, 15) мускулатура.
При изоляции отдельных органов друг от друга нужно остерегаться повреждения их стенок, чтобы паразиты из одного органа через порез не могли попасть в другой или быть утерянными. При дальнейшем исследовании следует оберегать как вскрытую рыбу, так и извлеченные из нее органы от подсыхания, для чего их можно покрывать кусками мокрой, фильтровальной или газетной бумаги или ткани.
Для избежания переноса паразитов из одного места в другое и могущей возникнуть путаницы в отношении правильности определения локализации паразитов, во все время вскрытия следует тщательно мыть инструменты и пипетки (особенно тщательно и отдельно промывается снятая резиновая груша пипетки).
Каждый исследуемый орган должен быть внимательно осмотрен снаружи на предмет обнаружения на нем паразитов полости тела (личинок ленточных червей, сосальщиков, круглых червей и скребней), при снятии которых обязательно отмечается, с какого именно органа они сняты. При внутреннем исследовании органа (особенно это относится к кишечнику) все крупные, видимые простым глазом паразиты отбираются пинцетом или иглами и помещаются в чистую воду, затем орган просматривается по частям компрессорным методом под лупой при увеличении X 10 и X 20 для обнаружения мелких паразитов.
Компрессорный метод широко применяется советскими гельминтологами. Он состоит в том, что части органов или тканей или целые органы, если они не велики, а также соскобы со стенок кишечника или его содержимое небольшими частями закладываются между двумя стеклами (желательно размером 6X12 см) толщиной 3–4 мм и при некотором добавлении воды расплющиваются до прозрачности образовавшегося тонкого слоя. При последовательном просмотре стекол под лупой (продвигая стекло слева направо) можно обнаружить даже весьма мелких паразитов. Затем производится подсчет паразитов по систематическим группам и, под контролем глаза, одно стекло постепенно сдвигается с другого. Паразитов снимают с обоих стекол иглой или тонко оттянутой пипеткой и помещают, по группам же, в солонки с водой или с физиологическим раствором. При снятии паразитов следует все время следить, чтобы поверхность стекол не подсыхала.
Для исследования жабер на моногенетических сосальщиков компрессорный метод мало пригоден, так как найти и снять паразитов после сдвигания стекла с раздавленной ткани очень трудно.
ОБЩЕЕ ПОЛОЖЕНИЕ ПО ПАРАЗИТОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ РЫБ
При подозрении на инвазионное заболевание у рыб проводят полное паразитологическое исследование. Для исследования отбирают образцы (экземпляры) — живые или свежеуснувшие рыбы всех возрастных категорий из каждого водоема в следующих количествах: личинок и мальков — не менее 25 экземпляров, сеголеток—15. 25, годовиков — 10. 15, рыб остальных возрастных групп — 5. 10 экземпляров. Результаты исследования вносят в рабочий журнал, где указывают дату, место вылова рыб, пол, возраст, массу тела и длину рыбы, вид паразитов (по данным предварительного и окончательного определения).
Исследования органов проводят в следующем порядке: кожа, плавники, ротовая полость, жабры, глаза, кровь, сердце, брюшная полость, печень, селезенка, плавательный пузырь, мочевой пузырь, почки, половые органы, кишечник, мышцы, головной и спинной мозг. Для обнаружения кровепаразитов у рыб берут кровь из сердца и делают мазки.
Исследование внешних покровов. При наружном осмотре кожного покрова и плавников собирают, предварительно определяют и фиксируют для последующего изучения всех паразитов, видимых простым глазом (паразитические, ракообразные, пиявки и др.). После этого с целью обнаружения микроскопических паразитов проводят микроскопию мазков из соскобов со всей поверхности тела (мальки, сеголетки, годовики) или из нескольких участков (крупной рыбы). Скальпелем соскабливают слизь с кожного покрова и плавников, помещают ее на предметное стекло и смешивают с ранее нанесенными туда же 2. 3 каплями прокипяченной воды. Накрывают покровным стеклом и рассматривают сначала под лупой, а потом при малом увеличении микроскопа. Исследование рыб на выявление возбудителя костиоза ведут при сильном увеличении микроскопа. Кроме возбудителя костиоза на коже рыб паразитируют и другие жгутиконосцы, а также инфузории, моногенетические сосальщики, пиявки, паразитические рачки. Весьма часто можно обнаружить споровиков, локализующихся в дермальных бугорочках.
Подсчет числа крупных паразитов (рачков, гельминтов) проводят в абсолютных числах, а мелких (споровиков, инфузорий и других простейших) — в относительных, т. е. подсчитывают число паразитов в десяти полях зрения микроскопа и определяют средние показатели. При этом рассчитывают экстентивность и интенсивность инвазии каждого паразита в отдельности для каждого вида и возраста рыб.
При осмотре кожного покрова необходимо учитывать, что паразиты могут локализоваться в толще кожи (метацеркарии Postliodiplostomum cuticala) и самой чешуи (метацеркарии Methagonimus).
В случае затруднения видового определения тех или иных паразитов их консервируют в соответствующих жидкостях, этикетируют и сохраняют для дальнейшей обработки.
Исследование жабр. Все жаберные дуги вынимают, помещают на предметное стекло, собирают всех видимых паразитов, подсчитывают и фиксируют. Соскоб с жаберных лепестков или целые жаберные дуги (сеголеток) с несколькими каплями воды зажимают между двумя предметными стеклами до прозрачности и исследуют при малом увеличении микроскопа.
Споровики, некоторые инфузории и личинки сосальщиков могут находиться не на поверхности жаберных лепестков, а в особых соединительнотканных образованиях — бугорках; обнаружить и извлечь их можно только после разрыва стенки бугорка с помощью препаровальных игл. В кровеносных сосудах жабр могут находиться яйца сангвиникол, споры и мицелии гриба.
Исследование глаз. Для обнаружения паразитов в глазах существует два метода исследования.
Первый метод. Глаза извлекают из глазных впадин, помещают на предметное стекло и вскрывают острыми ножницами с внутренней каудальной стороны. Извлеченное стекловидное тело, хрусталик и содержимое передней камеры глаза компрессируют двумя предметными стеклами и просматривают при малом увеличении микроскопа. В глазах можно обнаружить личинок сосальщиков и круглых червей.
Второй метод. Глаза из глазных впадин не извлекают, а острыми концами кривых глазных ножниц прокалывают склеру в центре и надрезают до края глаза с обеих сторон так, чтобы получился горизонтальный разрез. На оба края разреза накладывают ножницы с полуоткрытыми браншами и слегка надавливают. Под давлением хрусталик глаза выходит на поверхность разреза вместе со стекловидным телом. Его подхватывают сведенными браншами ножниц и переносят на стекло. Исследуют так же, как при первом методе.
Исследование брюшной полости и органов. Делают дугообразный разрез к основанию левого грудного плавника от анального отверстия, вводя непосредственно в него тупой конец одной из бранш ножниц. Вскрытую брюшную полость осматривают, крупных паразитов (лигула, филометра, амфилина) извлекают, а имеющиеся на серозных покровах и брыжейке бугорки исследуют под микроскопом.
Сердце. Для исследования сердце помещают в бактериологическую чашку с физиологическим раствором, вскрывают его полости, промывают образовавшийся осадок и исследуют под микроскопом на наличие возбудителя сангвиниколеза и некоторых метацеркариев.
Печень. При наружном осмотре можно обнаружить на поверхности печени личинок круглых червей и белые бугорки с заключенными в них личинками ленточных червей. Чтобы обнаружить паразитов, обитающих внутри печени, ее делят на небольшие кусочки, которые компрессируют и исследуют под лупой и затем при слабом увеличении микроскопа.
Желчный пузырь. Для обнаружения паразитов желчный пузырь вырезают, помещают на предметное стекло, разрезают ножницами и делают соскоб с внутренней оболочки стенки. Со- скоб и сам желчный пузырь помещают между двумя предметными стеклами и исследуют под лупой и микроскопом.
В желчном пузыре можно обнаружить простейших, сосальщиков и личинок ленточных червей.
Селезенка. Помещают между двумя стеклами, сжимают до прозрачности и исследуют под микроскопом.
Почки. Для обнаружения паразитов почки компрессируют и исследуют под микроскопом. В почках можно обнаружить крупных паразитов, споровиков и яйца сосальщиков.
Плавательный пузырь. Наружную волокнистую оболочку плавательного пузыря снимают, при этом паразиты, находящиеся в стенке плавательного пузыря и его полостях, обычно хорошо видны. Их извлекают и исследуют. В случае необходимости соскоб с внутренней оболочки плавательного пузыря микро- скопируют компрессорным методом.
Мочевой пузырь. Методика исследования сходна с исследованием желчного пузыря. В мочевом пузыре можно обнаружить сосальщиков, споровиков, инфузорий.
Половые органы. Для обнаружения паразитов железу по частям компрессируют между двумя стеклами и просматривают под микроскопом. В половых органах можно обнаружить микроспорий и крупных плероцеркоидов в фиброматозных сумках и свободно передвигающихся между икринками.
Желудочно-кишечный тракт. Пищевод, желудок и кишечник извлекают, освобождают от жира и печени, расправляют и вскрывают ножницами, начиная с пищевода. По ходу вскрытия обнаруженных крупных паразитов (ленточных и круглых червей, сосальщиков) извлекают и помещают в физиологический раствор. Содержимое из различных отделов желудочно-кишечного тракта исследуют компрессорным методом под микроскопом. Затем скальпелем делают глубокий соскоб со слизистой оболочки из нескольких мест и исследуют на наличие микроскопических паразитов (кокцидии и др.).
Исследование мышц. Для обнаружения плероцеркоидов ленте- цов и других крупных паразитов мышцы рыб разрезают на тонкие пластинки толщиной 5 мм и исследуют макроскопически. С целью обнаружения мелких паразитов небольшие кусочки мышц из различных частей рыбы исследуют компрессорным методом под лупой и под микроскопом при малом увеличении.
Исследование головного и спинного мозга. Исследуют компрессорным методом. В этих органах можно обнаружить споровиков.
Исследование хрящей. Для обнаружения возбудителя миксозо- моза (вертежа лососевых) исследуют компрессорным методом черепные и межпозвоночные хрящи.
Паразитологические исследования рыбы
Исследование и оценка доброкачественности морской рыбы проводится согласно “Методики паразитологического инспектирования морской рыбы и рыбной продукции” (Утв. Минрыбхозом СССР 1988г.).
Паразитологическое обследование морской рыбы начинают с внешнего осмотра рыбы. Его проводят обычно невооруженным глазом, что позволяет выявить: визуально заметные паразиты, прикрепленные или прилипшие к поверхности тела, его полости или на разрезах мяса рыбы; пятна и включения, отличающиеся по цвету или консистенции от окружающих их нормальных тканей, а также различные опухолевидные образования или участки мяса разжиженной консистенции. Как правило, паразиты имеют четкие контуры. Они находятся в свободном или инцистированном состоянии. Темные пятна на поверхности тела или в мясе рыб могут быть следами прикрепления здесь паразитических ракообразных, жгутиконосцев, моногеней или некоторых других паразитов.
Обследование внутренних органов начинают с внешнего осмотра. На серозных покровах органов или под ними могут быть обнаружены инкапсулированные личинки цестод и нематод. Особое внимание нужно обращать на личинок нематод, свернутых в плоские спирали.
Обследование мускулатуры ведется используя методы: параллельных разрезов мышечной ткани (разрезают поперек волокон на ломтики толщиной 5-10мм и просматривают их в падающем свете); просмотра мышечной ткани на просвет (с подсветкой снизу); просмотра сдавленных между двумя стеклами кусочков мышечной ткани – компрессорный метод.
По результатам проведенных исследований учитывают: какие встречаются паразиты, в каком состоянии и в каком количестве.
В первую очередь определяют паразитов, опасных для человека. Поскольку точное определение видов личинок вообще трудно (требуются высокая подготовка специалиста и специальное оборудование), рекомендуется считать потенциально опасными паразитов, внешний облик которых похож на личинок, изображенных на рис. 25 (помечены звездочкой).
Потенциально опасны гельминты, личинки которых находятся в рыбе в живом состоянии. Поэтому следует определить их жизнеспособность. Исследования проводят в отношении личинок, обнаруженных в свежей и охлажденной рыбе, если ее предполагается в таком виде направить на пищевое использование. В мороженой рыбе определение жизнеспособности личинок производится только в том случае, если со времени ее заморозки прошло менее двух месяцев. В течение этого срока все личинки в мороженой рыбе погибают.
Определение жизнеспособности личинок гельминтов может осуществляться следующими методами:
– м е т о д ф и з и ч е с к о г о р а з д р а ж е н и я. Личинок нематод, цестод и скребней помещают в бактериологическую чашку на фильтровальную бумагу, обильно смоченную физиологическим раствором. Личинок рассматривают в бинокуляр. Если личинки живые, то через 1-2мин. можно заметить их слабую подвижность. Их движения можно стимулировать уколом личинки препаровальной иглой. Если личинка жизнеспособная, то укол вызывает сокращение тела. Метацеркарии трематод, заключенные в цисту, помещают на предметное стекло, добавляют сверху несколько капель воды или физраствора, накрывают сверху другим стеклом и помещают под микроскоп. Просмотр цист в течение нескольких минут позволяет заметить медленное движение внутри их метацеркариев, если они живые. Стимулировать движения можно путем осторожного надавливания на верхнее стекло, чтобы было видно легкое сдавливание оболочек цист.
– м е т о д э л е к т р и ч е с к о г о с т и м у л и р о в а н и я. Применяется только к личинкам нематод, цестод и скребней ( но не к метацеркариям трематод) и требует наличия источника слабого постоянного тока (0,5-1,5 В). Два тонких изолированных провода от положительного и отрицательного полюсов элемента подводятся к двум препаровальным иглам. Личинок, лежащих в тонком слое воды или на мокрой фильтровальной бумаге, нужно коснуться одновременно обеими иглами, наблюдая под бинокуляром наличие или отсутствие движения.
– м е т о д х и м и ч е с к о г о в о з д е й с т в и я применим особенно к метацеркариям трематод. Личинок помещают в маленький объем 0,5%-го раствора трипсина, приготовленного на физрастворе ( лучше при 36-37 о С). Если личинки жизнеспособны, раствор стимулирует их движение, а инцистированные метацеркарии трематод начинают выходить из цист (в течение 5 мин.).
Исследования пресноводной рыбы,а также проходных и полупроходных рыб, в теле которых могут содержаться паразиты пресноводного происхождения, проводят согласно требований “Правил ветеринарно-санитарной экспертизы пресноводной рыбы и раков” ( 1989 ).
При подозрении на зараженность рыб возбудителями гельминтозоонозов (описторхоз, клонорхоз, дифиллоботриоз и др.) в лабораторию направляют 15 экземпляров каждого вида рыб из данного водоема, партии или упаковки. Мелкие рыбы берут целиком, от крупных рекомендуют брать пробы.
Паразитологическое исследование проводят согласно существующим методикам исследования рыб при инвазионных заболеваниях.
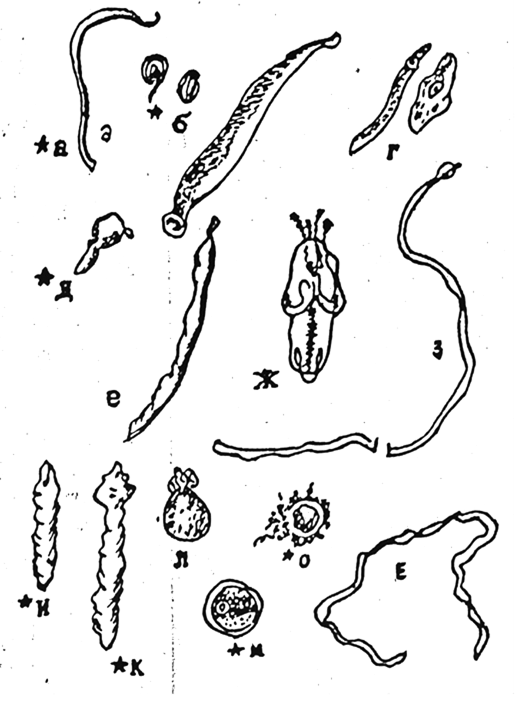
Рис. 25. Гельминты морских рыб:
а,б-нематоды длина чаще всего от 1 до 6 см); в- пиявки (длина от 1 до
12 см); г,н-взрослые трематоды (длина от 0,5 мм до 10 см); м,о – метацеркарии трематод в цистах (диаметр цист от 0.2 до 6 мм); д,е – скребни (длина от 6мм до 6 см); ж – личинка цестоды Нибелини (длина 0,1 – 12 мм); з, и , к, л -личинки цестод различных групп (длина от 1 мм до 20 см). Звездочками (*) отмечены группы личинок гельминтов, среди которых могут быть опасные для человека виды.
Дата добавления: 2015-10-19 ; просмотров: 414 . Нарушение авторских прав














